通知公告
我院药物临床试验机构临床试验
安全性事件报告流程(试行)
新版《药物临床试验质量管理规范》于2020年7月1日开始实施,0638太阳集团根据相关法规要求,更新了我院开展的药物临床试验安全性事件报告的流程,请各方按照更新流程报告安全性事件,携手保护受试者的安全。
一、药物临床试验严重不良事件(Serious Adverse Event,SAE)报告流程
1.本院来源SAE:除试验方案或者其他文件(如研究者手册)中规定不需立即报告的SAE外,研究者应在获知后24小时内报告申办者、药物临床试验机构和伦理委员会,随后及时补充随访、总结报告。如申办者对于研究者向其报告SAE另有时限要求,应有书面约定。注意:研究者应在获知受试者发生SAE后即刻向本项目的主要研究者和机构办公室口头报告,并通知申办单位监查员,随后尽快完善书面报告。对于死亡事件报告,研究者还应当向申办者、药物临床试验机构和伦理委员会提供其他所需要资料,如尸检报告和最终医学报告。
申办者的评估意见返回后,如果无更新的意见和资料,研究者签收后报告给伦理委员会备案;如果申办者与研究者的判断不一致,尤其是与试验药物的相关性判断不一致(如申办者的评估降级或升级),研究者签收后报告给本机构和伦理委员会,可能涉及机构和伦理委员会需要重新评估临床试验受试者的风险。
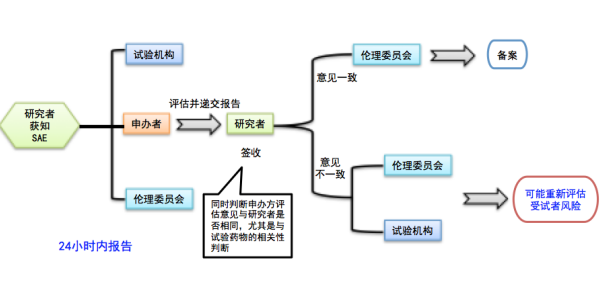
2.外院或其他来源 SAE:多中心药物临床试验的申办者以 SAE列表 + 个例报告的形式,按月度报告研究者,由研究者递交伦理委员会。SAE列表包括但不限于:中心名称、受试者鉴认代码、SAE疾病诊断、SAE情况、与试验药物的相关性、发生时间、报告时间、SAE来源(包括:外院、其它来源)。
注意:研究者接到申办者提交的SAE报告后,如涉及致死或危及生命的SAE,则需要在一个工作日内签收、阅读,以评估是否需要采取相关措施保护受试者安全和权益,并向临床试验机构和伦理委员会递交SAE递交信。
3.SAE报告内容:详见附件1《严重不良反应(SAE)报告表》报告模板。书面报告时,应当注明受试者在临床试验中的鉴认代码,应保证报告内容完整、准确,以提供申办者评估。如单例患者报告中包含多个SAE事件,需要描述清楚每一个SAE的特征(严重程度、起止时间、相关性判断等)。
二、可疑且非预期严重不良反应(SUSAR) 的报告
全部来源 SUSAR:多中心药物临床试验的申办者以 SAE列表 + 个例报告的形式,按月度分别报告给研究者,由研究者递交伦理委员会。设盲项目进行SUSAR报告递交时,申办者应注意保持盲态。SAE列表包括但不限于:中心名称、受试者鉴认代码、SAE疾病诊断、SAE情况、与试验药物的相关性、发生时间、报告时间、SAE来源(包括:外院、其它来源)。
注意:研究者在接到申办者提交的SUSAR报告后,如涉及致死或危及生命的SUSAR,则需要在一个工作日内签收、阅读,以评估是否需要采取相关措施保护受试者安全和权益,并向临床试验机构和伦理委员会递交SUSAR递交信。
三、机构对于SAE/ SUSAR报告的接收和处理
本中心机构指定专人具体负责SAE/ SUSAR报告和安全性更新报告的接收及电子版登记。机构接收SAE/ SUSAR报告和安全性更新报告后予以审核和存档,必要时和研究者沟通报告的内容和处理方式,与伦理委员会沟通并协同处理受试者保护事项。
四、申办者处理安全性事件
1.对安全性事件的数据收集及报告时限应符合2020年版GCP及《药物临床试验期间安全性数据快速报告标准和程序》要求,即:
1.1对于致死或危及生命的SUSAR评估报告,应在首次获知后尽快报告,但不得超过7天,并在随后的8天内报告、完善随访信息。注:申办者首次获知当天为第0天;
1.2对于非致死或危及生命的SUSAR评估报告,应在首次获知后尽快报告,但不得超过15天;
1.3申办者在首次报告后,应继续跟踪严重不良反应,以随访报告的形式及时报送有关新信息或对前次报告的更改信息等,报告时限为获得新信息起15天内;
1.4申办者从其它来源获得的与试验药物相关的SUSAR及其他潜在严重安全性风险的信息也应当向机构备案。无论境内、境外的个例安全性报告及其他潜在严重安全性风险报告原则上均应采用简体中文报告。对于原始资料为外文的报告,可以第一时间将外文版的报告进行递交,后续可以使用外文配合中文共同报告并递交;
2.申办者收到任何来源的安全性相关信息后,均应当立即分析评估,包括严重性、与试验药物的相关性以及是否为预期事件等。
3.申办者在评估事件的严重性和相关性时,如果与研究者持有不同的意见,特别是对研究者的判断有降级的意见(如:将研究者判断为相关的事件判断为不相关),必须写明理由。在相关性判断中不能达成一致时,其中任一方判断不能排除与试验药物相关的,也应快速报告。
4.申办者在撰写评估报告时,需要明确相关性判断的依据,应谨慎地判断相关性,在无确凿依据判断无关时,倾向于判断为有关。
5.申办者应当将SUSAR快速报告给所有参加临床试验的研究者及机构、伦理委员会;申办者应当向药品监督管理部门和卫生健康主管部门报告SUSAR。
6.快速报告开始时间和结束时间:快速报告开始时间为临床试验批准日期/国家药品审评机构默示许可开始日期,结束时间为国内最后一例受试者随访结束日期。
五、申办者递交DSUR和其他定期安全报告
研发期间安全性更新报告(Development Safety Update Report,以下统称:DSUR)的主要目的是对报告周期内收集到的与在研药物(无论上市与否)相关的安全性信息进行全面深入的年度回顾和评估。
1.申办者需要将DSUR有关信息通报给所有参加临床试验的研究者及其所在临床试验机构、伦理委员会。设盲项目进行DSUR递交时,申办者应注意保持盲态;特殊情形下(如紧急揭盲),可以根据方案约定通报相关方。
2.DSUR的具体撰写与递交要求,需参照ICH-E2F及国家药监局药品审评中心发布的《研发期间安全性更新报告要求及管理规定》。
3.报告时限参照ICH-E2F及CDE《研发期间安全性更新报告管理规范(试行)》,进行年度或更高频率的报告递交,原则上报告周期不超过一年。
注意:研究者应在接到申办者提交的DSUR报告后,如涉及致死或危及生命的DSUR,则需要在一个工作日内签收、阅读,以评估是否需要采取相关措施保护受试者安全和权益,并向临床试验机构和伦理委员会递交DSUR递交信。
参考文献:
1.《药物临床试验质量管理规范》,2020,国家药品监督管理局、国家卫生健康委员会
2.ICH《E2B(R2)安全性消息处理和个例安全性报告技术规范》,2018,国家药品监督管理局
3.药品审评中心发布《关于药物临床试验期间安全性数据快速报告标准和程序》有关事项的通知,2018,国家药品监督管理局药品审评中心
4.《研发期间安全性更新报告管理规范(试行)》,2020,国家药品监督管理局药品审评中心
5.《临床试验安全性报告工作指引(试行版)》,2020,中国临床研究能力提升与受试者保护高峰论坛(CCHRPP)
以上是我院药物临床试验安全性事件报告流程,从即日起施行。本规定解释权在我院药物临床试验机构办公室。 未尽事宜请联系0638太阳集团国家药物临床试验机构办公室,联系电话: 010-58303236,其他联系方式详见医院官网。
0638太阳集团
国家药物临床试验机构
2020年7月1日
点击下载附件:
上一篇: 0638太阳集团 药物临床试验机构院内…
下一篇: 0638太阳集团疫情防控战时状态下的临…